- Расчет водородного показателя для растворов разной кислотности
- Исследования
- Растворимость веществ в воде
- Таблица оксидов (2 часть):
- Строение молекулы воды
- Химическая формула
- В природе
- Растворимость веществ в воде
- Плотность воды в зависимости от температуры
- Таблица оксидов.
- Химические формулы веществ молекулярного строения
- Что такое вода аш2о
- Методы определения водородного показателя раствора
Расчет водородного показателя для растворов разной кислотности
Попробуем посчитать pH для чистой воды и нейтральных водных растворов:
pH= −lg = −lg10−7 = −(−7) = 7.
Для нейтральных водных растворов и чистой воды pH = 7.
Рассчитаем значения водородного показателя для раствора сильной одноосновной кислоты (например, HCl) концентрации 1 моль/л. Концентрация ионов водорода Н+ равняется также 1 моль/л. Подставим значения в ионное произведение воды, которое сохранит свое значение 10−14 и в этом растворе:
Кw = = [1 моль/л] × = 10−14.
В таком случае = 10 (так как 10 = 1 моль/л).
Тогда рН = −lg10 = 0.
Для растворов сильных кислот pH = 0.
Рассчитаем значения водородного показателя для раствора сильного основания (например, KOH) концентрации 1 моль/л. Ионное произведение воды принимает вид:
Кw = [1 моль/л] = 10−14.
Кw = [10 моль/л] = 10−14.
Тогда .
Следовательно, рН = −lg10−14 = 14.
Для растворов сильных оснований pH = 14.
Таким образом, значения pH могут варьироваться в интервале от 0 до 14. Чем меньше рН, тем выше кислотность среды. И наоборот: чем больше рН, тем выше щелочность среды.
Сильнокислотные свойства раствора характерны для pH = 0–3, а сильнощелочные — для pH = 12–14.
Значения pH в зависимости от характера среды:
-
в нейтральных водных растворах pH = 7;
-
в кислотных — pH < 7;
-
в щелочных — pH > 7.
Исследования
Происхождение воды на планете
Происхождение воды на Земле является предметом научных споров. Некоторые учёные считают, что вода была занесена астероидами или кометами на ранней стадии образования Земли, около четырёх миллиардов лет назад, когда планета уже сформировалась в виде шара. В настоящее время установлено, что вода появилась в мантии Земли не позже 2,7 миллиардов лет назад.
Гидрология
Гидроло́гия — наука, изучающая природные воды, их взаимодействие с атмосферой и литосферой, а также явления и процессы, в них протекающие (испарение, замерзание и т. п.).
Предметом изучения гидрологии являются все виды вод гидросферы в океанах, морях, реках, озёрах, водохранилищах, болотах, почвенных и подземных вод.
Гидрология исследует круговорот воды в природе, влияние на него деятельности человека и управление режимом водных объектов и водным режимом отдельных территорий; проводит анализ гидрологических элементов для отдельных территорий и Земли в целом; даёт оценку и прогноз состояния и рационального использования водных ресурсов; пользуется методами, применяемыми в географии, физике и других науках. Данные гидрологии моря используются при плавании и ведении боевых действий надводными кораблями и подводными лодками.
Гидрология подразделяется на океанологию, гидрологию суши и гидрогеологию.
Океанология подразделяется на биологию океана, химию океана, геологию океана, физическую океанологию, и взаимодействие океана и атмосферы.
Гидрология суши подразделяется на гидрологию рек (речную гидрологию, потамологию), озероведение (лимнологию), болотоведение, гляциологию.
Гидрогеология
Гидрогеоло́гия (от др.-греч. ὕδωρ «водность» + геология) — наука, изучающая происхождение, условия залегания, состав и закономерности движений подземных вод. Также изучается взаимодействие подземных вод с горными породами, поверхностными водами и атмосферой. В сферу этой науки входят такие вопросы, как динамика подземных вод, гидрогеохимия, поиск и разведка подземных вод, а также мелиоративная и региональная гидрогеология. Гидрогеология тесно связана с гидрологией и геологией, в том числе и с инженерной геологией, метеорологией, геохимией, геофизикой и другими науками о Земле. Она опирается на данные математики, физики, химии и широко использует их методы исследования. Данные гидрогеологии используются, в частности, для решения вопросов водоснабжения, мелиорации и эксплуатации месторождений.
Источник
Растворимость веществ в воде
- хорошо растворимые вещества — в 100 г воды растворяется более 1 г вещества при н.у.;
- малорастворимые вещества — в 100 г воды растворяется 0,01-1 г вещества;
- практически нерастворимые вещества — в 100 г водры растворяется менее 0,01 г вещества.
Совершенно нерастворимых веществ в природе не существует.
При растворении многих веществ в воде вокруг их молекул образуется оболочка из молекул воды — такой «слоеный пирог» называется гидратом. После кристаллизации в составе таких комплексов сохраняются некоторая часть молекул воды, образуя кристаллогидрат:
CuSO4+5H2O = CuSO4·5H2O
См. далее:
- Жесткость воды
- Пероксид водорода (H2O2)
Таблица оксидов (2 часть):
| 36 | Криптон | Kr | нет |
| 37 | Рубидий | Rb | Rb2O (оксид рубидия, окись рубидия) |
| 38 | Стронций | Sr | SrO (оксид стронция, окись стронция) |
| 39 | Иттрий | Y | Y2O3 (оксид иттрия, сесквиоксид иттрия) |
| 40 | Цирконий | Zr | ZrO2 (оксид циркония (IV), оксид циркония, диоксид циркония) |
| 41 | Ниобий | Nb | NbO (оксид ниобия (II), окись ниобия), Nb2O3 (оксид ниобия (III), окись ниобия), NbO2 (оксид ниобия (IV), окись ниобия), Nb2O5 (оксид ниобия (V), окись ниобия) |
| 42 | Молибден | Mo | Mo2O3 (оксид молибдена (III), окись молибдена), MoO2 (оксид молибдена (IV), окись молибдена), Mo2O5 (оксид молибдена (V), окись молибдена), MoO3 (оксид молибдена (VI), триоксид молибдена, триоксомолибден, молибдит) |
| 43 | Технеций | Tc | TcO2 (оксид технеция (IV), окись технеция (IV)), Tc2O7 (оксид технеция (VII), окись технеция (VII)) |
| 44 | Рутений | Ru | Ru2O3 (оксид рутения (III), окись рутения (III), сесквиоксид рутения), RuO2 (оксид рутения(IV), окись рутения (IV)), RuO4 (оксид рутения(VIII), тетраоксид рутения) |
| 45 | Родий | Rh | RhO (оксид родия (II), окисел родия), Rh2O3 (оксид родия (III), сесквиоксид родия), RhO2 (оксид родия (IV), окисел родия) |
| 46 | Палладий | Pd | PdO (оксид палладия (II), окись палладия), Pd2O3•n H2O (оксид палладия (III), окисел палладия), PdO2 (оксид палладия (IV), окисел палладия) |
| 47 | Серебро | Ag | Ag2O (оксид серебра (I)), Ag+1Ag+3O2 или Ag2O2 (оксид серебра (I,III), оксид серебра (III)-серебра (I), монооксид серебра, диоксид дисеребра) |
| 48 | Кадмий | Cd | Cd2O (оксид кадмия (I)), CdO (оксид кадмия (II)) |
| 49 | Индий | In | In2O (оксид индия (I), окись индия (I), гемиоксид индия, закись индия), InO (оксид индия (II), окись индия (II)), In2O3 (оксид индия (III)) |
| 50 | Олово | Sn | SnO (оксид олова (I), монооксид олова, олово окись (II), олово закись, олово одноокись), SnO2 (оксид олова (IV), окись олова, двуокись олова, диоксид олова, касситерит), Sn3O4 |
| 51 | Сурьма | Sb | Sb2O3 (оксид сурьмы (III), сесквиоксид сурьмы, сурьмянистый ангидрид), Sb2O5 (оксид сурьмы (V), пятиокись сурьмы, сурмяный ангидрид), Sb2O4 или SbIIISbVO4 (тетраоксид сурьмы, диоксид сурьмы) |
| 52 | Теллур | Te | TeO2 (оксид теллура (IV), диоксид теллура, теллурит, двуокись теллура, ангидрид теллуристой кислоты), TeO3 (оксид теллура (VI), триоксид теллура, трёхокись теллура, ангидрид теллуровой кислоты), Te2O5, Te4O9 |
| 53 | Йод | I | I+12O (монооксид дийода), I+2O (монооксид йода), I+4O2 (диоксид йода), I+3, +52O4 или I+3O(I+5O3) или (I+3, +5O2)2 (тетраоксид дийода, иодноватокислый йод), I+52O5 или O(IO2)2(оксид йода (V), пентаоксид дийода, иодноватый ангидрид), I+3, +54O9 или I+3(I+5O3)3 или I+3(OI+5O2)3 (иодат йода (III), иодноватокислый йод, нонаоксид тетрайода) |
| 54 | Ксенон | Xe | XeO2 (оксид ксенона (IV), диоксид ксенона), XeO3 (триоксид ксенона), XeO4 (тетраоксид ксенона) |
| 55 | Цезий | Cs | Cs2O (оксид цезия, окись цезия) |
| 56 | Барий | Ba | BaO (оксид бария, окись бария, безводный барит) |
| 57 | Лантан | La | La2O3 (оксид лантана (III), сесквиоксид лантана) |
| 58 | Церий | Ce | |
| 59 | Празеодим | Pr | |
| 60 | Неодим | Nd | |
| 61 | Прометий | Pm | |
| 62 | Самарий | Sm | |
| 63 | Европий | Eu | |
| 64 | Гадолиний | Gd | |
| 65 | Тербий | Tb | |
| 66 | Диспрозий | Dy | |
| 67 | Гольмий | Ho | |
| 68 | Эрбий | Er | |
| 69 | Тулий | Tm | |
| 70 | Иттербий | Yb |
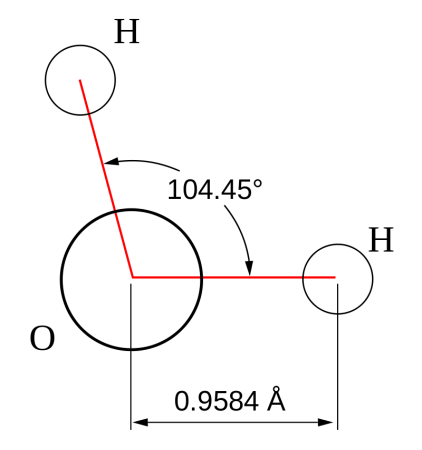
Строение молекулы воды
Молекула воды состоит из одного атома кислорода, который соединен с двумя атомами водорода, при этом связи O-H образуют угол в 104,5°, при при этом общие электронные пары смещены к атому кислорода, который более электроотрицателен по сравнению с атомами водорода, поэтому, на атоме кислорода формируется частичный отрицательный заряд, соответственно, на атомах водорода — положительный. Таким образом, молекулу воды можно рассматривать, как диполь.
Молекулы воды могут между собой образовывать водородные связи, притягиваясь противоположно заряженными частями (на рисунке водородные связи показаны пунктиром):
Формирование водородных связей объясняет высокую плотность воды, температуру ее кипения и плавления.
Количество водородных связей зависит от температуры — чем выше температура, тем меньшее кол-во связей образуется: в парах воды присутствуют только отдельные ее молекулы; в жидком состоянии — образуются ассоциаты (H2O)n, в кристаллическом состоянии каждая молекула воды связана с соседними молекулами четырьмя водородными связями.
Химическая формула
Химия — уникальная наука, которая обладает своим языком и «алфавитом». Каждый химический элемент имеет своё название и собственный «адрес» в периодической системе.
В этом разделе мы будем учиться составлять, читать химические слова, точнее на языке химии – формулы. Периодическая система служит алфавитом, она содержит 126 «букв». Но в ней содержатся только названия и символы элементов, но как они читаются не обозначено. Ниже приведены название и произношение наиболее употребляемых химических элементов.
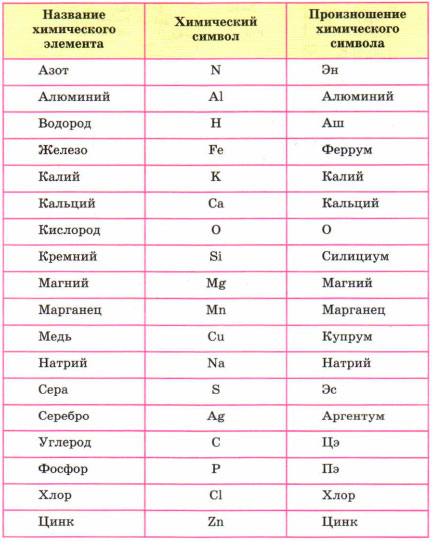
Например, самый лёгкий элемент – водород, но его символ читается как АШ. Кислород читаем – О. Медь – купрум.
Как записать и прочитать с чего состоит соединение, чтобы нас могли понять не только русскоговорящие, но и те, кто говорит на другом языке? Помогут нам в этом символы, а также индексы.

H2SO4 – зелёным цветом выделены индексы – маленькая цифра, которая записывается справа от символа. Он служит показателем количественного состава.
H2SO4 – красным выделены знаки элементов, они указывают качественный состав.
Рассмотрим примеры составления формул, используя условные обозначения на рисунке.
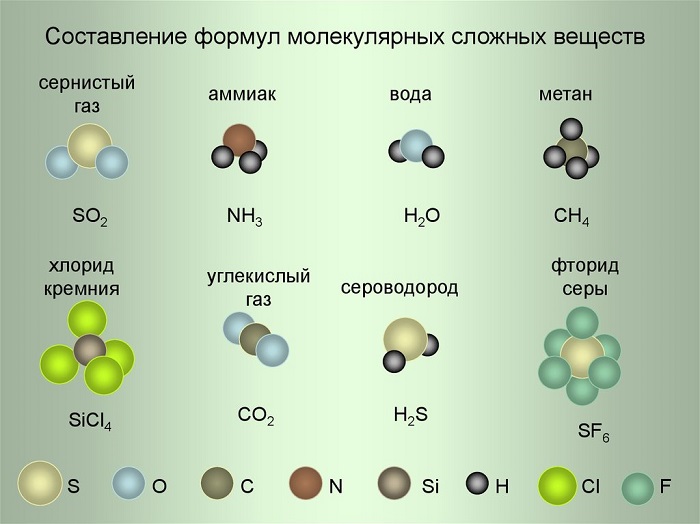 (Источник)
(Источник)
- Сернистый газ. Из условных обозначений видим, что он состоит из одного атома Серы и двух атомов Кислорода – SO2, читается как эс-о-два.
- Аммиак. Один атом Азота и три Водорода – NH3 (эн-аш-три).
- Фторид серы. Один атом Серы и шесть атомов Фтора – SF6 (эс-фтор-шесть).
Коэффициент записывается всегда в начале формулы и никогда не ставится в середину. С его помощью мы узнаём количество молекул, либо свободных атомов. Например, запись 6SiCl4 читаем как: шесть молекул хлорида кремния, 3H2S– 3 молекулы сероводорода.
В природе
В атмосфере нашей планеты вода находится в виде капель малого размера, в облаках и тумане, а также в виде пара. При конденсации выводится из атмосферы в виде атмосферных осадков (дождь, снег, град, роса). В совокупности жидкая водная оболочка Земли называется гидросферой, а твёрдая — криосферой. Вода является важнейшим веществом всех живых организмов на Земле. Предположительно, зарождение жизни на Земле произошло в водной среде.
Мировой океан содержит более 97,54 % земной воды, ледники — 1,81 %, подземные воды — около 0,63 %, реки и озера — 0,009 %, материковые солёные воды — 0,007 %, атмосфера — 0,001 %.
Вода за пределами Земли
Вода — чрезвычайно распространённое вещество в космосе, однако из-за высокого внутрижидкостного давления вода не может существовать в жидком состоянии в условиях вакуума космоса, отчего она представлена только в виде пара или льда.
Одним из наиболее важных вопросов, связанных с освоением космоса человеком и возможности возникновения жизни на других планетах, является вопрос о наличии воды за пределами Земли в достаточно большой концентрации. Известно, что некоторые кометы более, чем на 50 % состоят из водяного льда. Не стоит, впрочем, забывать, что не любая водная среда пригодна для жизни.
В результате бомбардировки лунного кратера, проведённой 9 октября 2009 года НАСА с использованием космического аппарата LCROSS, впервые были получены достоверные свидетельства наличия на спутнике Земли водяного льда в больших объёмах.
Вода широко распространена в Солнечной системе. Наличие воды (в основном в виде льда) подтверждено на многих спутниках Юпитера и Сатурна: Энцеладе, Тефии, Европе, Ганимеде и др. Вода присутствует в составе всех комет и многих астероидов. Учёными предполагается, что многие транснептуновые объекты имеют в своём составе воду.
Вода в виде паров содержится в атмосфере Солнца (следы), атмосферах Меркурия (3,4 %, также большие количества воды обнаружены в экзосфере Меркурия), Венеры (0,002 %), Луны, Марса (0,03 %), Юпитера (0,0004 %), Европы, Сатурна, Урана (следы) и Нептуна (найден в нижних слоях атмосферы).
Содержание водяного пара в атмосфере Земли у поверхности колеблется от 3—4 % в тропиках до 2·10 −5 % в Антарктиде.
Кроме того, вода обнаружена на экзопланетах, например HD 189733 A b, HD 209458 b и GJ 1214 b.
Жидкая вода, предположительно, имеется под поверхностью некоторых спутников планет — наиболее вероятно, на Европе — спутнике Юпитера.
Растворимость веществ в воде
- хорошо растворимые вещества — в 100 г воды растворяется более 1 г вещества при н.у.;
- малорастворимые вещества — в 100 г воды растворяется 0,01-1 г вещества;
- практически нерастворимые вещества — в 100 г водры растворяется менее 0,01 г вещества.
Совершенно нерастворимых веществ в природе не существует.
При растворении многих веществ в воде вокруг их молекул образуется оболочка из молекул воды — такой «слоеный пирог» называется гидратом. После кристаллизации в составе таких комплексов сохраняются некоторая часть молекул воды, образуя кристаллогидрат:
Если вам понравился сайт, будем благодарны за его популяризацию Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки:
Источник
Плотность воды в зависимости от температуры
Принято считать, что плотность воды равна 1000 кг/м3, 1000 г/л или 1 г/мл, но часто ли мы задумываемся при какой температуре получены эти данные?
Максимальная плотность воды достигается при температуре 3,8…4,2°С. В этих условиях точное значение плотности воды составляет 999,972 кг/м3. Такая температурная зависимость плотности характерна только для воды. Другие распространенные жидкости не имеют максимума плотности на этой кривой — их плотность равномерно снижается по мере роста температуры.
Вода существует как отдельная жидкость в диапазоне температуры от 0 до максимальной 374,12°С — это ее критическая температура, при которой исчезает граница раздела между жидкостью и водяным паром. Значения плотность воды при этих температурах можно узнать в таблице ниже. Данные о плотности воды представлены в размерности кг/м3 и г/мл.
В таблице приведены значения плотности воды в кг/м3 и в г/мл (г/см3), допускается интерполяция данных. Например, плотность воды при температуре 25°С можно определить, как среднее значение от величин ее плотности при 24 и 26°С. Таким образом, при температуре 25°С вода имеет плотность 997,1 кг/м3 или 0,9971 г/мл.
Значения в таблице относятся к пресной или дистиллированной воде. Если рассматривать, например, морскую или соленую воду, то ее плотность будет выше — плотность морской воды равна 1030 кг/м3. Плотность соленой воды и водных растворов солей можно узнать в этой таблице.
| t, °С | ρ, кг/м3 | ρ, г/мл | t, °С | ρ, кг/м3 | ρ, г/мл | t, °С | ρ, кг/м3 | ρ, г/мл |
|---|---|---|---|---|---|---|---|---|
| 999,8 | 0,9998 | 62 | 982,1 | 0,9821 | 200 | 864,7 | 0,8647 | |
| 0,1 | 999,8 | 0,9998 | 64 | 981,1 | 0,9811 | 210 | 852,8 | 0,8528 |
| 2 | 999,9 | 0,9999 | 66 | 980 | 0,98 | 220 | 840,3 | 0,8403 |
| 4 | 1000 | 1 | 68 | 978,9 | 0,9789 | 230 | 827,3 | 0,8273 |
| 6 | 999,9 | 0,9999 | 70 | 977,8 | 0,9778 | 240 | 813,6 | 0,8136 |
| 8 | 999,9 | 0,9999 | 72 | 976,6 | 0,9766 | 250 | 799,2 | 0,7992 |
| 10 | 999,7 | 0,9997 | 74 | 975,4 | 0,9754 | 260 | 783,9 | 0,7839 |
| 12 | 999,5 | 0,9995 | 76 | 974,2 | 0,9742 | 270 | 767,8 | 0,7678 |
| 14 | 999,2 | 0,9992 | 78 | 973 | 0,973 | 280 | 750,5 | 0,7505 |
| 16 | 999 | 0,999 | 80 | 971,8 | 0,9718 | 290 | 732,1 | 0,7321 |
| 18 | 998,6 | 0,9986 | 82 | 970,5 | 0,9705 | 300 | 712,2 | 0,7122 |
| 20 | 998,2 | 0,9982 | 84 | 969,3 | 0,9693 | 305 | 701,7 | 0,7017 |
| 22 | 997,8 | 0,9978 | 86 | 967,8 | 0,9678 | 310 | 690,6 | 0,6906 |
| 24 | 997,3 | 0,9973 | 88 | 966,6 | 0,9666 | 315 | 679,1 | 0,6791 |
| 26 | 996,8 | 0,9968 | 90 | 965,3 | 0,9653 | 320 | 666,9 | 0,6669 |
| 28 | 996,2 | 0,9962 | 92 | 963,9 | 0,9639 | 325 | 654,1 | 0,6541 |
| 30 | 995,7 | 0,9957 | 94 | 962,6 | 0,9626 | 330 | 640,5 | 0,6405 |
| 32 | 995 | 0,995 | 96 | 961,2 | 0,9612 | 335 | 625,9 | 0,6259 |
| 34 | 994,4 | 0,9944 | 98 | 959,8 | 0,9598 | 340 | 610,1 | 0,6101 |
| 36 | 993,7 | 0,9937 | 100 | 958,4 | 0,9584 | 345 | 593,2 | 0,5932 |
| 38 | 993 | 0,993 | 105 | 954,5 | 0,9545 | 350 | 574,5 | 0,5745 |
| 40 | 992,2 | 0,9922 | 110 | 950,7 | 0,9507 | 355 | 553,3 | 0,5533 |
| 42 | 991,4 | 0,9914 | 115 | 946,8 | 0,9468 | 360 | 528,3 | 0,5283 |
| 44 | 990,6 | 0,9906 | 120 | 942,9 | 0,9429 | 362 | 516,6 | 0,5166 |
| 46 | 989,8 | 0,9898 | 125 | 938,8 | 0,9388 | 364 | 503,5 | 0,5035 |
| 48 | 988,9 | 0,9889 | 130 | 934,6 | 0,9346 | 366 | 488,5 | 0,4885 |
| 50 | 988 | 0,988 | 140 | 925,8 | 0,9258 | 368 | 470,6 | 0,4706 |
| 52 | 987,1 | 0,9871 | 150 | 916,8 | 0,9168 | 370 | 448,4 | 0,4484 |
| 54 | 986,2 | 0,9862 | 160 | 907,3 | 0,9073 | 371 | 435,2 | 0,4352 |
| 56 | 985,2 | 0,9852 | 170 | 897,3 | 0,8973 | 372 | 418,1 | 0,4181 |
| 58 | 984,2 | 0,9842 | 180 | 886,9 | 0,8869 | 373 | 396,2 | 0,3962 |
| 60 | 983,2 | 0,9832 | 190 | 876 | 0,876 | 374,12 | 317,8 | 0,3178 |
Следует отметить, что при увеличении температуры воды (выше 4°С) ее плотность уменьшается. Например, по данным таблицы, плотность воды при температуре 20°С равна 998,2 кг/м3, а при ее нагревании до 90°С, величина плотности снижается до значения 965,3 кг/м3. Удельная масса воды при нормальных условиях значительно отличается от ее плотности при высоких температурах. Средняя плотность воды, находящейся при температуре 200…370°С намного меньше ее плотности в обычном температурном диапазоне от 0 до 100°С.
Смена агрегатного состояния воды приводит к существенному изменению ее плотности. Так, величина плотности льда при 0°С имеет значение 916…920 кг/м3, а плотность водяного пара составляет величину в сотые доли килограмма на кубический метр. Следует отметить, что значение плотности воды почти в 1000 раз больше плотности воздуха при нормальных условиях.
Кроме того, вы также можете ознакомиться с таблицей плотности веществ и материалов.
Таблица оксидов.
Поделитесь информацией:
Оксиды: основные оксиды, кислотные оксиды, амфотерные оксиды:
Оксид (именуемые также окисел, окись) – это бинарное соединение химического элемента с кислородом в степени окисления −2, в котором сам кислород связан только с менее электроотрицательным элементом.
Химический элемент кислород по электроотрицательности находится на втором месте после фтора, поэтому к оксидам относятся почти все соединения химических элементов с кислородом. Исключение составляет, например, дифторид кислорода OF2.
В зависимости от химических свойств различают:
— солеобразующие оксиды:
- основные оксиды. К ним относятся оксиды металлов, степень окисления которых +1, + 2;
- кислотные оксиды. К ним относятся оксиды металлов со степенью окисления +5, + 6, + 7, и оксиды неметаллов;
- амфотерные оксиды. К ним относятся оксиды металлов со степенью окисления +3, +4, и оксиды-исключения: ZnO, BeO, SnO, PbO;
— несолеобразующие оксиды: оксид углерода (II) СО, оксид азота (I) N2O, оксид азота (II) NO, оксид кремния (II) SiO и оксид серы (II) SO.
В зависимости от количества атомов элементов в оксиде, кроме кислорода различают:
— простые, включающие в молекулу атомы одного элемента, кроме кислорода, и находящихся в в одной степени окисления. Например, оксид лития Li2O.
— сложные оксиды, включающие в молекулу атомы двух и более элементов, кроме кислорода. Например, оксид лития-кобальта (III) Li2O·Co2O3;
— двойные оксиды, в которые атомы одного и того же элемента входят в двух или более степенях окисления. Например, оксид марганца (II, IV) Mn5O8. Во многих случаях такие оксиды могут рассматриваться как соли кислородсодержащих кислот.
Химические формулы веществ молекулярного строения
Формулы двухатомных молекул: кислорода — О2 («о-два»), хлора — Сl2 («хлор-два»), азота — N2 («эн-два»). Трехатомная молекула озона и восьмиатомная молекула серы обозначаются формулами О3 («о-три») и S8 («эс-восемь»).
Формулы молекул сложных веществ также отображают их качественный и количественный состав. Например, формула воды, как вы уже, наверное, хорошо знаете, Н2О («аш-два-о»), метана — СН4 («це-аш-четыре»), а аммиака — NH3 («эн-аш-три»). Точно так же читаются формулы любых сложных веществ. Например, формула серной кислоты — H2SO4 («аш-два-эс-о-четыре»), а глюкозы — C6H12O6 («це-шесть-аш-двенадцать-о-шесть»).
Химические формулы веществ молекулярного строения (их называют молекулярными формулами) показывают состав элементарных частей, т. е. условных «кирпичиков», из которых состоят эти вещества. Такими элементарными составными частями (элементарными структурными единицами, или просто структурными единицами) в данном случае являются молекулы.
Что такое вода аш2о

| Вода | |
|---|---|
 | |
 | |
| Систематическоенаименование | Оксид водородаВода |
| Традиционные названия | вода |
| Хим. формула | H2O |
| Состояние | жидкость |
| Молярная масса | 18,01528 г/моль |
| Плотность | 0,9982 г/см 3 |
| Твёрдость | 1,5 |
| Динамическая вязкость | 0,00101 Па·с |
| Кинематическая вязкость | 0,01012 см²/с (при 20 °C) |
| Скорость звука в веществе | (дистиллированная вода) 1348 м/с |
| Т. плав. | 273,1 K (0 ° C) |
| Т. кип. | 373,1 K (99,974 ° C) °C |
| Тройная точка | 273,2 K (0,01 ° C), 611,72 Па |
| Кр. точка | 647,1 K (374 ° C), 22,064 МПа |
| Мол. теплоёмк. | 75,37 Дж/(моль·К) |
| Теплопроводность | 0,56 Вт/(м·K) |
| Удельная теплота испарения | 2256,2 кДж/кг |
| Удельная теплота плавления | 332,4 кДж/кг |
| Показатель преломления | 1,3945 , 1,33432 , 1,32612 , 1,39336 , 1,33298 и 1,32524 |
| Рег. номер CAS | 7732-18-5 |
| PubChem | 962 |
| Рег. номер EINECS | 231-791-2 |
| SMILES | |
| RTECS | ZC0110000 |
| ChEBI | 15377 |
| ChemSpider | 937 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. |

Вода (оксид водорода) — бинарное неорганическое соединение с химической формулой H 2 O : молекула воды состоит из двух атомов водорода и одного — кислорода, которые соединены между собой ковалентной связью. При нормальных условиях представляет собой прозрачную жидкость, не имеющую цвета (при малой толщине слоя), запаха и вкуса. В твёрдом состоянии называется льдом (кристаллы льда могут образовывать снег или иней), а в газообразном — водяным паром. Вода также может существовать в виде жидких кристаллов (на гидрофильных поверхностях).
Вода является хорошим сильнополярным растворителем. В природных условиях всегда содержит растворённые вещества (соли, газы).
Исключительно важна роль воды в глобальном кругообороте вещества и энергии, возникновении и поддержании жизни на Земле, в химическом строении живых организмов, в формировании климата и погоды. Вода является важнейшим веществом для всех живых существ на Земле.
Всего на Земле около 1400 млн кубических километров воды. Вода покрывает 71 % поверхности земного шара (океаны, моря, озёра, реки, льды — 361,13 млн квадратных километров). Бо́льшая часть земной воды (97,54 %) принадлежит Мировому океану — это солёная вода, непригодная для сельского хозяйства и питья. Пресная же вода находится в основном в ледниках (1,81 %) и подземных водах (около 0,63 %), и лишь небольшая часть (0,009 %) в реках и озерах. Материковые солёные воды составляют 0,007 %, в атмосфере содержится 0,001 % от всей воды нашей планеты.
Методы определения водородного показателя раствора
Характер среды (кислый, нейтральный или щелочной) определяют с помощью индикатора.
Индикаторы — вещества, которые изменяют окраску раствора при различных значениях pH.
Чтобы определить характер среды, в исследуемый раствор достаточно добавить несколько капель водно-спиртового раствора индикатора — и окраска последнего изменится.
На практике наиболее распространены несколько индикаторов: метилоранж, лакмус и фенолфталеин. Окраска этих индикаторов в кислой, нейтральной и щелочной среде представлена в таблице:
Определение pH среды с помощью индикатора — быстрый и наглядный метод, но для определения более точного значения pH используют универсальный индикатор.
Универсальный индикатор представляет собой смесь высушенных веществ, нанесенных на бумагу. С его помощью можно определить характер среды в широком диапазоне pH — от 1 до 14.
Для измерения водородного показателя pH на бумажную полоску наносят исследуемый раствор, а затем сравнивают цвет индикатора с эталонной шкалой.
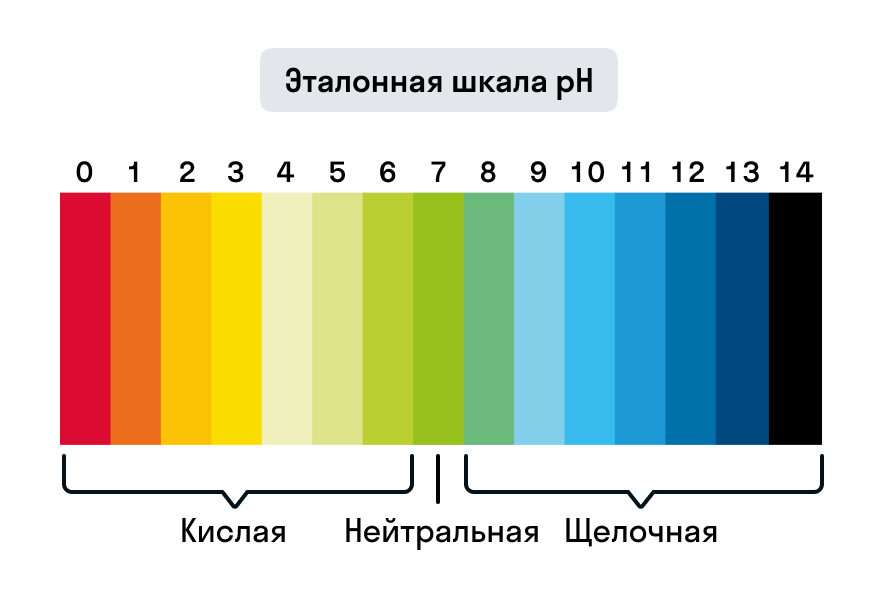
Помимо определения характера среды, с помощью индикатора можно отследить изменение концентрации компонента в растворе. Например, реакция нейтрализации (реакция между кислотой и щелочью) протекает без каких-либо признаков (выпадения осадка или выделения газа). Но если к раствору кислоты добавить индикатор лакмус, раствор окрасится в красный, а после добавления к нему щелочи — в фиолетовый. Изменение окраски индикатора подтвердит протекание реакции нейтрализации.
Использование специального прибора pH-метра позволяет измерять значения pH в более широком интервале и с большей точностью (до 0,01 единицы pH) по сравнению с индикаторами.
Работа pH-метра основана на измерении электродвижущей силы (ЭДС), которая создается электродами после погружения в раствор.